为了打赢疫情防控阻击战——检验人在行动之七十九:中检集团汇总各国口罩等防疫产品技术要求及进口应急措施

近期,我们将向大家分享最全面、最准确的口罩等个人防护用品和医疗器械认证指南,帮助企业顺利高效地开展相关产品出口业务,为打好新冠肺炎疫情防控全球阻击战,有效开展国际联防联控贡献力量。
如需了解下列国家具体的口罩认证及出口流程,请关注我们的公众号,在公众号后台回复“口罩”或进入“口罩认证”菜单查询更详细的信息!
如需将您的口罩或其他医疗器械产品出口至国外,请与我们的工程师联系,请将您的企业名称、地址、产品名称和您的联系方式,以邮件的形式发送到:icd@cqc.com.cn,我们会尽快给您回复!
中国1
商务部 海关总署国家药品监督管理局公告2020年第5号 关于有序开展医疗物资出口的公告
当前,全球疫情呈加速扩散蔓延态势。在做好自身疫情防控的基础上,有序开展医疗物资出口是深化疫情防控国际合作、共同应对全球公共卫生危机的重要举措。在疫情防控特殊时期,为有效支持全球抗击疫情,保证产品质量安全、规范出口秩序,自4月1日起,出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的企业向海关报关时,须提供书面或电子声明(模版见附件1),承诺出口产品已取得我国医疗器械产品注册证书(相关注册信息见附件2),符合进口国(地区)的质量标准要求。海关凭药品监督管理部门批准的医疗器械产品注册证书验放。上述医疗物资出口质量监管措施将视疫情发展情况动态调整。
有关医疗物资出口企业要确保产品质量安全、符合相关标准要求,积极支持国际社会共同抗击疫情。
附件:
1.出口医疗物资声明模板.doc
2.我国相关医疗器械产品注册信息(国家药监局网站www.nmpa.gov.cn动态更新).xlsx
商务部 海关总署 国家药品监督管理局
2020年3月31日
欧盟2
2020年3月13日,欧盟委员会在欧洲官方杂志(Official Journal of the EuropeanUnion)发布了疫情期间针对医疗器械(包括外科口罩、医用检查手套和隔离服)和个人防护用品(包括口罩、防护手套、全身防护服、防护镜)的合格评定和市场监管程序的建议(Commission Recommendation (EU) 2020/403,不具有法律约束力,仅仅是为欧盟法的解释提供一个指引、建议和说明),将疫情期间急需的个人防护用品和医疗器械监管权力从公告逐步转向了市场监管。该建议中的重点内容总结如下:
1.对于医疗器械(medical device, MD)
►如未完成合格评定程序––市场监督机构确定产品符合医疗器械的基本安全和性能要求––产品可在一定时间内进行销售,同时继续完成其合格评定过程。
►如没有CE标志––由官方或授权机构采购,仅可提供给医疗工作者使用,不能在市场上流通销售––由市场监督部门进行抽查。
2.对于个人防护用品(personal protective equipment, PPE)
►如未完成合格评定程序––市场监督机构确定产品符合PPE法规的基本健康和安全要求––产品可在一定时间内进行销售,同时继续完成其合格评定过程。
►如采用与PPE法规基本健康与安全要求同等水平的技术要求,如WHO推荐要求––公告机构发证,并立即通知主管当局和其它PPE法规的公告机构。
►如没有CE标志––由官方或授权机构采购,仅可提供给医疗工作者使用,不能在市场上流通销售––由市场监督部门进行抽查。
更多信息请参考(请点击阅读):
美国3
►1. 减免关税––美国贸易代表处
据路透社报道,美国贸易代表处3月12日宣布,不对部分从中国进口的医药品加征关税。这些医药品包括口罩、听诊器、血压计袖带等。这一决定出于目前新冠疫情正在对美国健康医疗体系造成冲击。此前美国贸易代表处已将洗手液、医用手套等进口产品移出征税清单。
原文链接:https://ustr.gov/about-us/policy-offices/press-office/press-releases/2020/march/ustr-response-coronavirus-crisis
►2. N95口罩供应策略––CDC
3月17日,美国疾病控制与预防中心(Centers for Disease Control and Prevention, CDC)发布《优化N95口罩供应策略:危机/替代策略》。新冠肺炎疫情期间,当N95口罩供给不足时,按下表中标准生产的口罩,可以作为N95口罩的替代品,其中包括采用中国标准GB 2626-2006 和GB/T 18664–2002生产的口罩。但是,这只是CDC的建议,FDA并没有正式发布这些是否可以替代NIOSH标准走简化的FDA流程。

原文链接:https://www.cdc.gov/coronavirus/2019-ncov/hcp/respirators-strategy/crisis-alternate-strategies.html
►3.紧急使用授权––FDA
为了解决抗击疫情过程中出现的口罩短缺问题,美国食品药品监督管理局(Food and Drug Administration, FDA)于 2020 年 3 月 24 日签发了针对非 NIOSH 批准的 N95一次性过滤式面罩呼吸器的紧急使用授权(EUA)。说明无须FDA介入的PPE类型,EUA申请可提交至FDA进行审查,以简化流程,缩短拿到批准的时间。在 3 月 24 日的授权书中,FDA 得出的结论认为,某些进口的未经过 NIOSH 批准的一次性过滤式面罩呼吸器如果按照 CDC 防止穿戴者接触病原性生物空气传播颗粒的建议进行使用,在疫情爆发期间一次性过滤式面罩呼吸器短缺的情况下,则仍然可能适合保护公众健康或安全。
3月28日,FDA推出了一个新的紧急使用授权(Emergency Use Administration, EUA),声明可以满足指定性能标准的可接受的呼吸器产品只有六个国家和地区,将中国排除在名单之外。中国企业的应对措施之一可以是在提高并保证自己医疗产品质量的同时尽快申请美国 FDA 和 NIOSH 的相关注册和认证,拿到产品出口美国的通行证,用实力证明自身的实力。

原文链接:https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-takes-action-increase-us-supplies-through-instructions-ppe-and
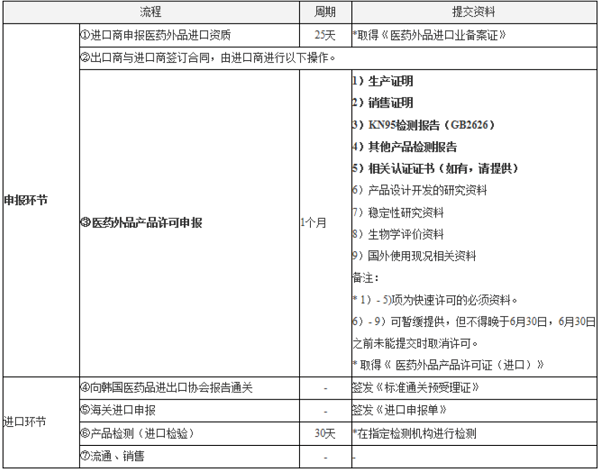
韩国4
依据食药处应对新冠病毒支援部发布的最新消息,
医药辅助类口罩,保健用(包括手术用)口罩,用于非商业用途的救助、捐赠及企业发放给职员时,可申请产品免检,需提交申请书和使用计划书,可以迅速进口。
用于商业销售类口罩产品可进行快速许可,许可审查部门的联系方式如下:
►首尔地方食药厅医药品安全管理科02-2640- -1413
►釜山地方食药厅医疗产品安全科051-602-6187
►京仁地方食药厅医疗产品安全科02-2110-8097、8072
►大邱地方食药厅医疗产品安全科053-589-2757
►光州地方食药厅医疗产品安全科062- 602-1541, 1455
►大田地方食药厅医疗产品安全科042-480-8768
(联系以获取进口业务报关单和产品授权书,并迅速处理进口要求。)
该政策至2020年6月30日有效,详情见相关网站:

俄罗斯5
2020年3月19日俄罗斯卫生监督局发布新的规则:将在五天内签发医用口罩、防护服和手套的注册证书。
俄罗斯政府简化了36种医疗器械的注册程序,包括呼吸器,医用口罩,隔热服和防护服以及手套和鞋套。俄罗斯卫生监督局将在收到初始注册申请资料后的五天内做出注册决定。之后制造商将需在五个月内确认注册产品的安全性和质量。如果资料与声明的参数不一致,则注册将被取消。
进行首次注册时,申请人必须向俄罗斯卫生监督局提供授权书,技术和操作文件,需进行医疗设备类型的照片以及文件清单。相关部门必须在三天内审核提交的文件内容,并且在没有索赔的情况下,必须在五天内签发证明。
提交文件后的150天内,申请人必须提交完整的医疗器械申请技术资料包,包括根据卫生部要求进行的临床,毒理学和技术研究的结论,并确认制成该产品的质量和安全性。如果不遵守规定,俄卫生监督局可以取消先前签发的注册证书。
简化法规涵盖的医疗设备清单包括36个项目,包括检查和治疗手套,医用口罩和呼吸器,绝缘和手术服,鞋套和手术衣。
目前欧亚经济委员会发布消息称,将对用于预防新冠肺炎病毒传播的商品进口临时实施零关税。零关税进口政策涉及2020年3月16日-9月30日进口到欧亚经济联盟境内的医疗物资,包括口罩、医用手套、消毒剂等。
沙特阿拉伯6
针对此次COVID-2019全球范围内的大爆发,SFDA也已采取相应紧急措施,放松进口限制,加快注册流程,并为沙特本地工厂和分销公司提供所有支持,以确保法规不会对紧急状况下挽救生命的医疗器械的供应产生阻碍。
为了确保沙特有足够的医疗设备和所需产品供应,现已采用以下新的监管干预措施:
1.进口个人防护用品(PPE)
- SFDA会加快评估过程,并在确保其安全后的两个工作日内签发医疗个人防护设备(PPE)的医疗设备销售许可(MDMA),例如医用口罩,医用手套和一次性防护服。
- 在通过MDMA完成注册之前,可以向发行公司提供临时进口许可证
- 当没有医疗口罩时,医疗服务提供者可以在紧急情况下使用N95口罩
2.当地未经授权的个人防护设备(PPE)工厂
- 组织SFDA代表团队进行审核访问,以确保原材料和整个制造过程的安全性和质量。如果生产过程的安全性和质量是可接受的,将在紧急危机期间颁发临时许可证。
- 制造商应稍后在SFDA注册并满足所有制造要求,包括获得授权机构的ISO 13485认证。
3.IVD kits(体外诊断试剂盒)的紧急进口许可
SFDA正在为专门用于新型冠状病毒(COVID-2019)的IVD试剂盒(用于研究用途)签发紧急批准和进口许可。
来源:中检集团
地址:北京市朝阳区华严北里甲1号健翔山庄C11座
电子邮件:ccib@vip.163.com 联系电话: 010-82021949








